N88-BASICで水素イオン指数(pH) (2回目)
2021/10/26(火)
N88-BASICで水素イオン指数(pH) (2回目)
酢酸水溶液のpH
CH3COOHaq(酢酸水溶液)の濃度
[CH3COOH]から[H+]とpHを求める
酢酸の電離定数(電離の平衡定数)は
Ka = [CH3COO-][H+]/[CH3COOH]
と定義され
Ka = 2.69×10-5 (mol/L) (25℃)
[CH3COOH] = c (mol/L), 電離度α
とすると
CH3COOH → CH3COO- + H+
←
最初c 0 0
反応-cα +cα +cα
平衡c-cα cα cα
= c(1-α)
平衡状態の濃度は
[CH3COOH] = c(1-α)
[CH3COO-] = cα, [H+] = cα
なので
Ka = [CH3COO-][H+]/[CH3COOH]
= cαcα/c(1-α)
= cα2/(1-α)
ここで
(1-a)Σai (i=0~n-1)
= 1+a+...+an-1 - (a+...+an)
= 1-an
Σai (i=0~n-1)
= (1-an)/(1-a)
0≦a<1としてn→∞とすると
1/(1-a) = 1+a+a2+a3+...
弱酸より0≦α<1を満たすので
Ka = cα2/(1-α)
= cα2(1+α+α2+α3+...)
= cα2+cα3+cα4+...
ここで|α|<<1(十分小さい)
(例α=0.01,α2=0.0001,α3=0.000001)
ならcα3以降は十分に小さく0に近似すると
Ka ≒ cα2 と近似できるので
α ≒ √(Ka/c)
つぎに、近似を使わない式を考えます
Ka = cα2/(1-α)を変形して
cα2 + Kaα - Ka = 0
α = (-Ka + √(Ka2+4cKa)) / (2c) (α≧0より)
https://ulprojectmail.blogspot.com
N88-BASICで水素イオン指数(pH) (1回目)
より
として
x = {-c' + √(c'2 + 4Kw)} / 2 (x≧0より)
[H+] = c' + {-c' + √(c'2 + 4Kw)} / 2
pH = -log10[H+] ([H+]=10-aとしたときのaの値)
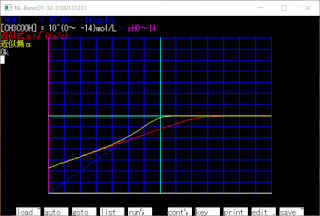
濃度c = 10(0 ~ -14)mol/L , pH = 0~14として
-log10c - pHグラフを表示しました
NL-BASICとblg~.zip(ph002.bas)は
このブログ(以下のリンク)から
ダウンロードできます