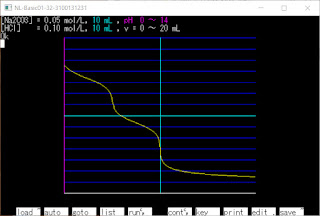
N88-BASICで滴定曲線 (3回目)
2021/11/3(水)
N88-BASICで滴定曲線 (3回目)
2価の弱酸と1価の強塩基の塩(B2A)を
1価の強酸(HC)で滴定(二段階滴定)
[Na2CO3aqをHClaqで滴定]
水溶液(H2O)中に
[H2A],[HA-],[H+],[A2-],[B+],[OH-],[C-]
が存在する
Ca = [A2-] + [H2A] + [HA-] … 酸の濃度
Cb = [B+] … 強塩基の濃度
Cc = [C-] … 強酸の濃度
Kw = [H+][OH-] … 水のイオン積
Ka1 = [HA-][H+]/[H2A] … 酸の電離定数(第1)
Ka2 = [A2-][H+]/[HA-] … 酸の電離定数(第2)
[B+] + [H+] = 2[A2-] + [HA-] + [OH-] + [C-]
… 電気的中性(電荷の合計を比較している)
前回の
https://ulprojectmail.blogspot.com/2021/11/n88-basic-2.html
N88-BASICで滴定曲線 (2回目)
で使用した式
2[A2-] + [HA-] + [OH-] - [B+] - [H+] = 0が
2[A2-] + [HA-] + [OH-] - [B+] - [H+] + [C-] = 0
になるので
の[B+]-[C-](Cb-Cc)を[B+](=Cb)に置き換えると
同じ式
[H+]4 + (Ka1 + Cb)[H+]3
+ {(Ka1(Ka2 + Cb - Ca) - Kw}[H+]2
+ Ka1{Ka2(Cb - 2Ca) - Kw}[H+]
- Ka1Ka2Kw = 0
になる
Mh、Mcを塩、酸それぞれのモル濃度、
Vhを塩の体積、Vcを酸の滴定量とし
V = Vh + Vc
Ca = MhVh/V
Cb = 2Ca (2価の酸+1価の塩基の塩)
Cc = McVc/V
前回の式に代入するため
Cb ← Cb - Ccと置き
滴定するたびに現在のモル濃度
Ca, Cbを計算し
上記、4次方程式をNewton法で解いて
滴定曲線(滴定量-pHのグラフ)を
描画しています
プログラム中で使用している数値は
適当に調べて書いていますので
正しいかどうかは自己責任で確かめて
下さい
炭酸ナトリウム水溶液と塩酸の反応式
Na2CO3 + HCl → NaCl + NaHCO3
NaHCO3 + HCl → NaCl + H2CO3 (CO2 + H2O)
Newton法は以下で説明しています
https://ulprojectmail.blogspot.com/2021/10/n88-basic-1.html
N88-BASICで天体の軌道(1回目)
NL-BASICとblg~.zip(neut003.bas)は
このブログ(以下のリンク)から
ダウンロードできます
https://ulprojectmail.blogspot.com
Readme.txtを読んで遊んで下さい