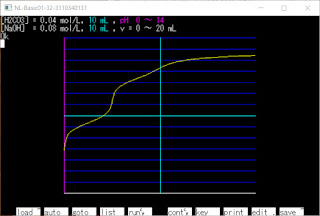
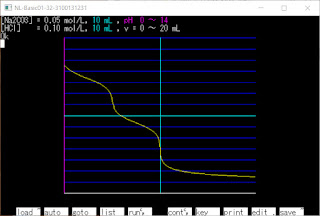
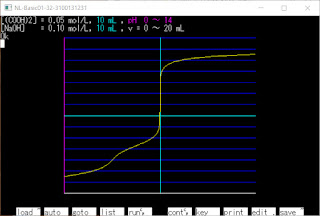
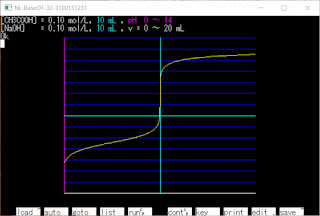
N88-BASICで滴定曲線 (5回目)
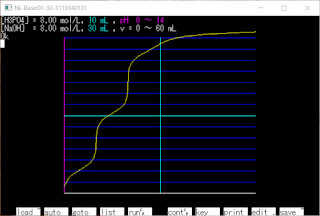
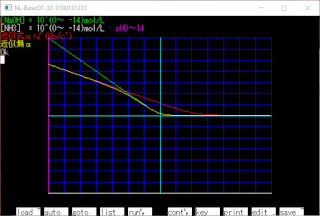
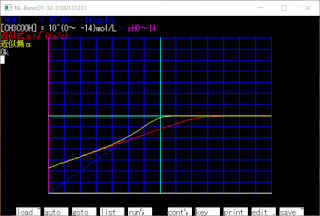
2021/11/5(金) N88-BASICで滴定曲線 (5回目) 3価の酸と1価の強塩基の滴定曲線 (弱塩基だと式が複雑になりすぎたので 強塩基のみで式を作りました) [H 3 PO 4 aqをNaOHaqで滴定] 水溶液(H 2 O)中に [H 3 A],[H 2 A - ],[HA 2- ],[H + ],[A 3- ],[B + ],[OH - ] が存在する Ca = [A 3- ] + [H 3 A] + [H 2 A - ] + [HA 2- ] … 酸の濃度 Cb = [B + ] … 強塩基の濃度 Kw = [H + ][OH - ] … 水のイオン積 Ka1 = [H 2 A - ][H + ]/[H 3 A] … 酸の電離定数(第1) Ka2 = [HA 2- ][H + ]/[H 2 A - ] … 酸の電離定数(第2) Ka3 = [A 3- ][H + ]/[HA 2- ] … 酸の電離定数(第3) [B + ] + [H + ] = 3[A 3- ] + 2[HA 2- ] + [H 2 A - ] + [OH - ] … 電気的中性(電荷の合計を比較している) これを連立させる (適当に求めたので煩雑かもしれません) ⇒ [B + ] = Cb Ka3 = [A 3- ][H + ]/[HA 2- ] ⇒ [HA 2- ] = [A 3- ][H + ]/Ka3 Ka2 = [HA 2- ][H + ]/[H 2 A - ] ⇒ [H 2 A - ] = [HA 2- ][H + ]/Ka2 = [A 3- ][H + ] 2 /(Ka2Ka3) Ka = Ka1Ka2Ka3 = [A 3-- ][H + ] 3 /[H 3 A] = [A 3-- ][H + ] 3 /(Ca - [A 3- ] - [HA 2- ] - [H 2 A - ]) ⇒ [A 3- ][H + ] 3 - Ka(Ca - [A 3- ] - [HA 2- ] - [H 2 A - ]) = 0 ⇒ [A 3- ][H + ] 3 - Ka{Ca - [A 3- ] - [A 3- ][H + ]/Ka3 - [A 3- ][H + ] 2 /(Ka2Ka3)} = 0 ⇒ [A 3- ]Ka2Ka3[H + ] 3 - Ka(C